1. Jelatin Eritme Deneyi:
Taze kültür, nutrient jelatin besiyeri bulunan tüplere inoküle edilir. 25 0C’ de 72 saat inkübasyona bırakılır. Buzdolabında soğutulan tüplerde jelatinin donup donmadığı kontrol edilir. Negatif tüplerde 1 hafta süreyle inkübasyona devam edilir. Ps. aeruginosa genellikle kısa sürede jelatinaz özelliği gösterir.
2. Camp Testi:
Camp testi özellikle kanlı agarda paralel çizimle ekim yapıldığında, türleri tanımlamada kullanılan yararlı bir testtir. Testin uygulanmasında, koyun kanlı agarda karşıt taraflara paralel olarak çizilen beta hemolitik S. aureus ve Rhodococcus equi kültürü kullanılır. Kültür, kanlı agara paralel halde uygulanan, S. aureus ve R. equi çizimlerine dik olarak çizilen paraleller şeklinde uygulanır. 35 0C’ de 24 – 48 saat inkübasyon sonrası hemoliz kontrol edilir. Kanlı agar her zaman kullanılandan daha ince olursa hemoliz daha kolay görülür. L. monocytogenes 24 saatte daha iyi sonuç verir. R. equi’ nin büyümesini daha iyi izlemek için 24 saatten daha uzun süre inkübe edilir. Kanlı agarda bilinen bir Listeria spp. İle kontrol edilmesi tavsiye edilir. Kullanılan kültürler haftalık taze kültürler olmalıdır. Yatay çizgilerin (Listeria sp. kültürüne ait), dikey çizgilere değmeyecek şekilde ayırarak çizilmelidir. 35 0C’ de 24 ve 48 saatlik inkübasyon sonrası dikey çizgilere yakın zondaki hemoliz kontrol edilir. Camp testinde ATCC tipi çeşitli kültürler kullanılabilir. L. monocytogenes ve L. seeligeri’ nin hemolizleri S. aureus çizgisinin yakınında daha fazladır, L. ivanovii’ nin hemolizi R. equi çizgisinin yakınında daha fazladır. Diğer türler hemolitik değildir ve bu testte reaksiyon vermezler. Camp testi L. ivanovii’ yi L. seeligeri’ den ayırır ve L. seeligeri’ nin haftalık hemolizi (hemolitik yapmayabilirde) L. welshimeri’ den ayrılır. Hemolizin üretimi dışında isolatların L. monocytogenes için verdiği reaksiyonlar tipiktir ve L. innocua hemolitik olmayan olarak tanımlanmadan önce camp testi yapılmalıdır.
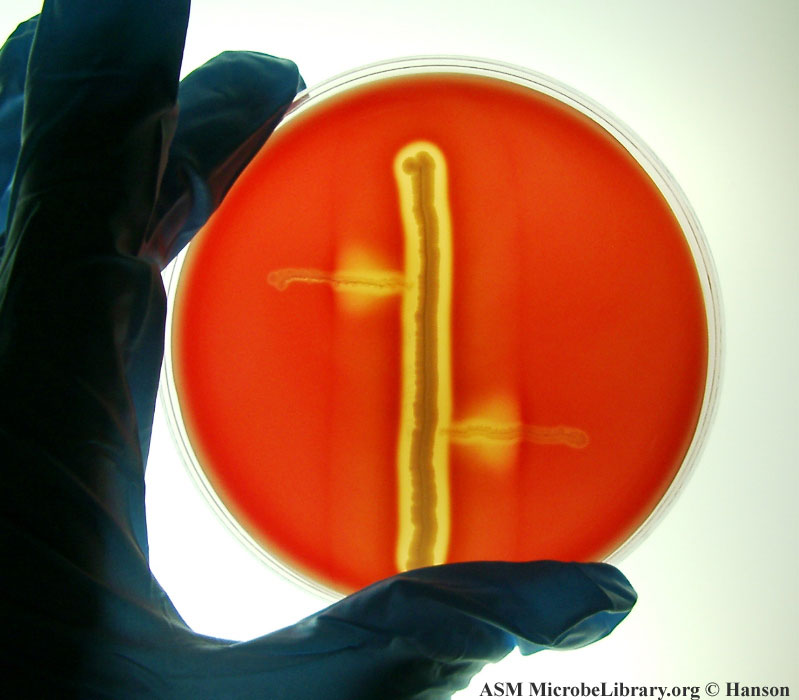
S. auerus kültürü ile hazırlanmış koyun kanlı agar, L. monocytogenes ile L. seeligeri’ nin hemolizin oluşumunu kolaylaştırıcı bir faktördür.
3. Metil Red – Voges Proskauer Testi (MR – VP):
MR-VP besiyerine inoküle edilen saf suş 37 °C’ da 48 saat inkübasyona bırakılır. Bu kültürden 1 ml aseptik ortamda başka bir tüpe VP testinde kullanılmak üzere aktarılır. Geri kalan kültür MR testinde kullanılır.
Metil Red Testi:
İnkübasyondan sonra kültürlere ve kontrol tüpe 5 – 6 damla metil kırmızısı solüsyonu katılır. Tüpler çalkalanır ve hemen sonuç okunur. Pozitif testlerde parlak kırmızı renk oluşur. Negatif testlerde sarı renk verir.
Voges – Proskauer Testi:
İnkübasyon süresi sonunda ayrılan 1 ml kültür tüpüne 0,6 ml alfa – naftol solüsyonu, 0,2 ml KOH solüsyonu konarak iyice çalkalanır. Sonuç 10 – 15 dakika içinde okunur. Pozitif reaksiyonlar en geç 5 dakika içinde parlak kırmızı renk ile belirlenir. Kontrol tüplerinde renk oluşmamalıdır.
4. Sitrat Kullanımı Testi:
Test edilecek saf kültürler Simmons citrate besiyerinde inoküle edilip 37°C’ da 96 saat inkübe edilir. Sitrat negatif kültürlerin inoküle edildiği besiyerinde üreme görülmezken, Sitrat pozitif kültürlerde üreme (besiyerinin maviye dönüşümü) gözlenir.
5. H2S Deneyi:
Kurşun asetat agar veya kurşun asetatlı kağıt kullanılarak H2S deneyi uygulanır. İncelenecek kültür pepton – sistin – sülfat besiyerine inoküle edilir. Kurşun asetatlı filtre kağıtları tüplerin ağzına pamukla sıkıştırılarak besiyerine değmeyecek şekilde yerleştirilir, ancak besiyerine çok uzak olmamalıdır. Tüpler 37°C’ da 2 – 7 gün inkübe edilir. Tüp içindeki kağıdın ucunun siyah renk alması H2S pozitif olarak değerlendirilir. Kontrol tüpteki kağıtta renk değişimi olmaz. Ayrıca TSİ Agar besiyerine inoküle edilen saf suşlar 37°C’ da 24 saat inkübasyondan sonra besiyerinde oluşan siyahlaşma ile ya da SİM besiyerine inoküle edilen saf suşlar 37°C’ da 24 saat inkübasyondan sonra besiyerinde oluşan siyahlaşma ile saptanabilir.
6. ONPG Testi:
ONPG (orthonitrophenil – β – α galakto pyranoside) hazır disk küçük deney tüpüne konur. Üzerine 0.1 cc fizyolojik tuzlu su eklenir. Test edilecek suşdan bir öze konur. 37°C’ da 6 – 24 saat inkübasyona bırakılır. Sarı renk oluşumu ONPG pozitif olarak değerlendirilir.
7. Lizin De Karboksilaz Testi (LDC):
TSİ besiyerindeki kültürde bu test uygulanabilir. 37°C’ da 18 saat inkübe edilen kültür üzerine 1 ml 5N NaOH solüsyonu konur, yavaşça çalkalanır. 2 ml kloroform ilave edilerek tekrar çalkalanır. Tüp eğik olarak yatırılarak çökme beklenir. Tüpün içindeki sıvının dip kısmındaki kloroformlu bölgeden pipetle 0,5 ml alınır, küçük bir tüpe aktarılır. Üzerine 0,5 ml ninhidrin solüsyonundan (%1’ lik ninhidrin kloroformda) eklenir. 37 °C’ lik etüvde bekletilir. Birkaç dakika içinde menekşe renginin oluşumu LDC pozitif olarak değerlendirilir. Negatif testlerde renk değişimi olmaz. Diğer bir alternatif olarak Lysine De Carboksilase besiyeri kullanılabilir. Lizin De Karboksilaz besiyerine direkt test edilecek suş inoküle edilir. 37°C’ da 24 saat inkübasyondan sonra renk değişimi kontrol edilir.

8. Karbohidratların Fermentasyonu:
Glikoz, laktoz ve sükroz olarak bakılır. Yatık TSİ besiyerine inoküle edilen suş 37°C’ da 24 saat inkübe edilir. İnkübasyon sonunda tüpün dibindeki sarıya dönen renk değişimi glikozun kullanıldığını, yatık yüzeydeki sarıya dönen renk değişimi laktozun kullanıldığını, yatık yüzeyin ucundaki sarıya dönen renk değişimi sukrozun kullanıldığını gösterir. Ayrıca (Norveç üçlü tüp metodunda kullanılan ikinci besiyerine) mannitol’ e geçilerek 37°C’ da 24 saat inkübasyondan sonra sarıya dönen renk değişimi ile mannitol fermantasyonu saptanır.
9. Üre Testi
Urease Broth besiyerinde üreyi kullanan bakteriler amonyak oluşturarak ortamın alkali olmasına neden olur. Kültür, Urease Broth besiyerine inoküle edilir ve 37°C’de 48 saat inkübe edilir. Besiyerinin orijinal portakal kırmızısı rengi sarıya dönerse sonuç negatif, kırmızıya dönerse pozitiftir.
10. Basit Boyama:
Preparat Hazırlama: Temiz bir lam üzerine, incelenecek mikroorganizma kültürü katı besiyerinde ise, cam baget yardımı ile bir damla su konulur. Bu su damlasının üzerine aseptik koşullarda bakteri kültüründen bir miktar ilave edilerek, kültür su damlası içinde iyice dağıtılır. Kültür sıvı ise doğrudan lam üzerine kültürden alınarak yayılır. Preparat kuruması için tozsuz bir yerde bırakılır. Preparat kuruduktan sonra, lamın alt yüzü 2 – 3 kez alevden geçirilerek mikroorganizmaların lam yüzeyine yapışmaları sağlanır.
Preparatın Boyanması: Tespit edilen preparatın üzerine karbol fuksin, metilen mavisi veya kristal violet boyalarından birinden birkaç damla damlatılır ve birkaç dakika beklenir. Sürenin bitiminde preparat su ile yıkanır. Preparat kuruduktan sonra mikroskopta incelenir.
A.Gram Boyama:
Kristal violet boyası, İyot-Lugol çözeltisi, Alkol ve Safranin kullanılarak yapılır.
Preparat 18 – 24 saatlik kültürden hazırlanmalıdır. Daha yaşlı kültür kullanıldığı takdirde yanlış sonuç alınabilir. Gram reaksiyonu değişken olan bazı Gram pozitif bakteriler Gram negatifmiş gibi değerlendirilebilir. Ayrıca Bacillus subtilis, B. Anthracis gibi bazı bakterilerde 2 saatlik kültürlerinde gram negatif özellik gösterdikleri halde zamanla pozitif özelliğe sahip olmaktadır.
Gram boyama yapmak için hazırlanmış preparatın üzerine kristal viyole boyası damlatılıp 1 dakika beklenir ve iyot – lugol çözeltisi ile yıkanarak kristal viyole uzaklaştırılır. Preparata tekrar iyot – lugol çözeltisi damlatılarak 1 – 2 dakika bekletilip, distile su ile yıkanarak iyot – lugol çözeltisi uzaklaştırılır. Preparatın üzerine %96’ lık etil alkol veya eter – aseton çözeltisi damlatılarak 10 – 15 saniye beklenir, distile su ile yıkanır ve karşıt boya olarak safranin damlatılır ve 20 – 30 saniye bekletilir. Preparat distile su ile yıkanarak havada kendi halinde kurumaya bırakılır, preparata immersiyon yağı damlatılır ve 100’ lük objektifle incelenir. Mor renkli bakteriler Gram pozitif, pembe renkli bakteriler ise Gram negatif olarak değerlendirilir.
B.Spor Boyama:
Basit boyamada anlatıldığı gibi preparat hazırlanır.
Preparat malaşit yeşili boyası ile alttan ısıtılarak ya da su banyosu üzerinde tutularak 5 dakika boyanır (boyanın kurumamasına dikkat edilir). Preparat su ile yıkanır, %0.5’ lik safranin ya da fuksinle 30 saniye boyanır. Preparat yıkanır, kurutulur ve immersiyon objektifi ile incelenir. Sporlar yeşil, hücreler kırmızı renkte görülürler.
Mikrobiyolojik analizlerinizde besiyeri başta olmak üzere pek çok ihtiyacınızı Diatek'ten karşılayabilirsiniz.
Hazır besiyerleri hakkında bilgi için TIKLAYINIZ.